原标题:滴度学院:世卫疫苗预认证,如何做有用的咨询?
2018年11月1日至2日, 一年一度的国际卫生安排(WHO)疫苗预认证(Prequalification, PQ)咨询会在我国昆明举行。和从前不同,本年的咨询会只采纳一对一的方式,即世卫疫苗预认证审评团队与各个国内疫苗厂商的小会。尽管没有了会集咨询会的部分,企业和国际安排无法进行预认证重要性和经历的评论与共享,但信任经过这几年的咨询会宣讲下来,咱们现已对预认证的重要性和含义了熟于心。何以见得?本年14家疫苗厂商积极参加一对一咨询便是最好的证明。
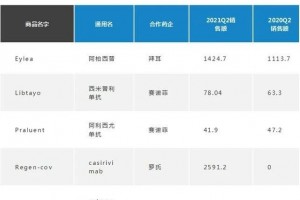
截止2018年11月,国内成功经过疫苗预认证的厂商和疫苗一共有4家,分别是成都所的乙脑,华兰的流感,科兴的灭甲以及北生研的bOPV.
在上一年北京的PQ咨询会上,小D有幸听到了科兴和北生研的预认证经历共享,最大的收成便是认识到了pre-submission meeting的重要性。即在正式的PQ申报之前,企业需求与世卫审评团队进行屡次交流与咨询,以保证了解世卫预认证的要求,并依据企业的实在的状况做距离剖析,后续延聘专家参谋团队进行咨询服务。
那么接下来小D想和咱们说的是,如何做有用的咨询?
首要,企业需求明晰拟申报PQ的疫苗是否有列入Vaccines prequalification priority list中,如若列入其间,则可申报。若未列入其间,也能够和世卫评定团队进行交流,世卫会归纳产品本身和国际需求等各方面状况酌情考虑是否承受企业的申报。
其次,确认具有申报资历后,企业需求全面了解世卫疫苗预认证的根本流程与要求(见附件一、二)。为了更好的推动我国疫苗厂商加入到世卫预认证的队伍中来,世卫驻华办专门设立了扩展免疫规划组,用于支撑国内疫苗厂商的预认证申报项目。企业应积极地与世卫驻华办联络,交流有无,精确了解疫苗预认证的利与弊、流程与要求,并经过屡次咨询后,确认是否发动预认证项目。
再次,确认发动预认证项目之后,企业应预备一次厂商和产品的全面咨询。详细包含预备一套拟申报PQ的产品文件,包括其厂房设备、研制、出产、质控、稳定性、非临床、临床等各方面信息,一起预备一份介绍用PPT及咨询清单。经过和世卫评定团队一对一的咨询,介绍产品的根本状况。经过发问与答疑的方式,开始点评PQ申报的距离和可能性。
接下来,依据全面咨询后的成果,企业对现有状况做距离剖析,明晰接下来项目展开的侧重点与优先次序,进行详细的咨询。一般企业的距离是在临床方面,例如短少出产规模接连3批一致性、非劣效性、联合接种等实验和数据。因而应优先展开临床咨询,确认需求补做的临床实验有哪些。与此一起,企业也应延聘参谋团队进行专门的GMP模仿查看和质量方面的咨询,点评是否有工艺改变或车间改造等方面的要求。
最终,在全面咨询和详细咨询之后,企业方能明晰地认识到本身的距离并进行必要整改,以契合世卫预认证的申报要求。因而,有用的pre-submission meeting是必不可少的,企业应充沛掌握好每一次pre-submission meeting的时机!
小D期望咱们咱们在阅览之后,能对世卫疫苗预认证多一些了解,让渐渐的变多的企业能成功经过预认证,让咱们优异的疫苗种类走出国门,被国际更多的国家所认可!
附件一:
附件二:
WHO 疫苗预认证流程图阐明
WHO疫苗预认证大致分为以下六个过程:
1递送请求
递送请求函,表达出产商进行产品预认证资质点评的意向。
请求函递送时刻不限,但需阐明可供给产品文件的估计时刻。
2举行评论会
由出产商、国家药监局负责人(若有)、WHO负责人一起参加评论,会上,出产商能够就预认证相关的问题进行咨询。
出产商可提出本身需求,WHO依据出产商的需求安排点评会议。
3产品概要文件(PSF)
若请求函经过,出产商须预备和递送产品概要文件(1份纸质档和5份CD格局的电子档)。该文件需遵循WHO格局,如下:
■ Chapter 1: General information;
■ Chapter 2: Personnel;
■ Chapter 3: Premises and equipment;
■ Chapter 4: Vaccine composition, presentations and schedules;
■ Chapter 5: Production;
■ Chapter 6: Quality control;
■ Chapter 7: Stability;
■ Chapter 8: Clinical experience;
■ Chapter 9: Production and distribution data;
■ Chapter 10: Update on regulatory actions.
补白:
- 认可并承受CTD格局,若运用CTD格局,文件需包括PSF中的一切内容。
- 递送产品材料的时刻节点为,每年1月31日、5月31日和9月31日。
3.1 PSF文件查看(1-4个月)
(1)查看PSF文件的完好性和规范性。文件查看有2轮。
若第1轮不经过,WHO将发正式通知函奉告出产商文件被驳回,并要求出产商付出相应的查看费用。
若经过第1轮查看,则不需求付出查看费用,直至第2轮点评完毕后,WHO将发正式通知函奉告出产商文件查看经过,并要求出产商付出相应的查看费用。
(2)查看该产品的项目适用性
预认证项目适用性点评委员会(PSPQ)将会对产品的要害特点、独特性和立异性进行点评。PSPQ的推荐函对WHO的批阅有着重要含义。
若材料缺乏,出产商须在1个月内对专家的点评做出弥补反应,做后续查看,若经过,PSPQ会发正式通知函奉告出产商,要求其付出相应查看费用。
若查看不经过,PSPQ会发正式通知函奉告出产商请求被驳回,要求其付出相应查看费用,一起WHO将毁掉该PSF文件。
3.2 PSF文件点评(6个月)
(1)第一轮文件点评耗时3个月,若点评过程中发现材料缺乏,WHO即将求出产商进行弥补反应(以1份纸质档和5份CD格局的电子档的方式递送)。若出产商未能在3个月内进行弥补,WHO将停止点评。
(2)第二轮文件点评耗时3个月,指在对收到弥补反应之后的完好文件进行点评。
4
样品查验(自递送样品之日起3个月)
PSF文件查看和点评经往后,出产商须供给必定数量的样品(25-200支不等),要求是接连3-5个批次,以及样品随附材料(批记载摘要、检测的新方法SOP、试剂、规范品等)
5
现场审计(自样检合格后2个月内进行)
验厂陈述将在查看完毕后1个月内发给出产商,一起抄送给国家药监局。若需整改,WHO将对整改项进行反应,出产商需在截止日期之前递送反应。
6
成果点评
若点评经过,WHO将会向联合国安排以及相关安排发布一份信件,声明该疫苗产品契合WHO及联合国等安排的要求,而且取得当国药监局的同意和证明,一起提呈陈述对所述现实进行弥补阐明。
该疫苗将会被归入疫苗预认证清单中。
预认证的资质至WHO建议从头点评之前一向有用。
关于滴度渠道
Drugdu滴度渠道——全球跨境医贸的B2B电子商务渠道。为您供给靠谱的医药、器械外贸常识,助力您的产品出海走国际。加小滴微Drugdu2了解更多医贸常识。
责任编辑: